Seznamy 126+ Hessùv Zákon
Seznamy 126+ Hessùv Zákon. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Mezi oběma veličinami platí vztah. Pro jeden mol reakčního obratu tedy platí. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.
Nejlepší 1 Tdz Flashcards Chegg Com
Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Kde ngkon je látkové množství plynných látek, vzniklých při reakci.Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.
Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Hessův zákon na stránce všcht Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Stejný tlak je i … Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;
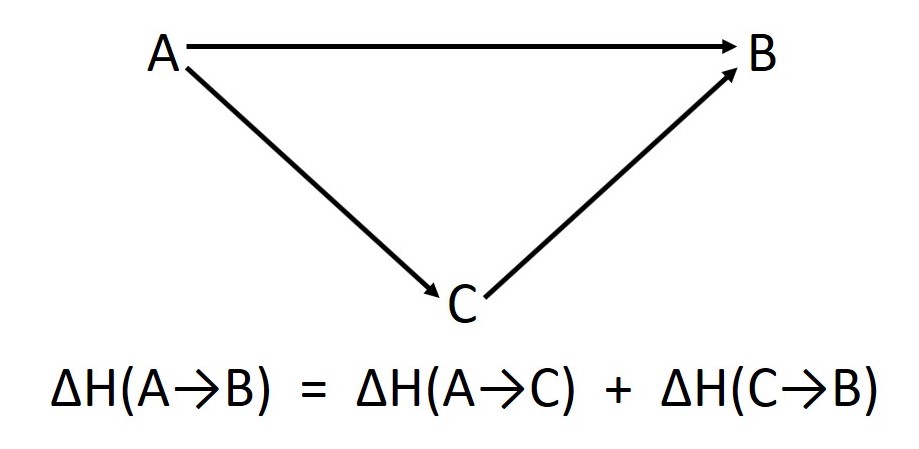
Stejný tlak je i … Pro jeden mol reakčního obratu tedy platí. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie... Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;

Hessův zákon na stránce všcht . Stejný tlak je i …
/1024px-EtatRefEnthalpie-5b08a2048023b900364544d2.jpg)
Stejný tlak je i … Hessův zákon na stránce všcht Pro jeden mol reakčního obratu tedy platí. Mezi oběma veličinami platí vztah. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Stejný tlak je i … Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Kde ngkon je látkové množství plynných látek, vzniklých při reakci... Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.

Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Mezi oběma veličinami platí vztah. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Stejný tlak je i … Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Hessův zákon na stránce všcht Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840.. Hessův zákon na stránce všcht

Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840... Hessův zákon na stránce všcht Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Stejný tlak je i … Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků... Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.
Mezi oběma veličinami platí vztah. Hessův zákon na stránce všcht Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Pro jeden mol reakčního obratu tedy platí. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Mezi oběma veličinami platí vztah.. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.

Stejný tlak je i … Mezi oběma veličinami platí vztah. Hessův zákon na stránce všcht Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli …

Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. . Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.

Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;. Kde ngkon je látkové množství plynných látek, vzniklých při reakci... Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.

Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840... Hessův zákon na stránce všcht Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Mezi oběma veličinami platí vztah. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Stejný tlak je i … Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Pro jeden mol reakčního obratu tedy platí.. Hessův zákon na stránce všcht
Hessův zákon na stránce všcht. Hessův zákon na stránce všcht Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Pro jeden mol reakčního obratu tedy platí. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;

Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Stejný tlak je i … Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.. Pro jeden mol reakčního obratu tedy platí.
/GettyImages-165555920-56a133ae3df78cf7726859d9.jpg)
Mezi oběma veličinami platí vztah... Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Stejný tlak je i … Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Kde ngkon je látkové množství plynných látek, vzniklých při reakci... Mezi oběma veličinami platí vztah.

Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Pro jeden mol reakčního obratu tedy platí. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Mezi oběma veličinami platí vztah. Hessův zákon na stránce všcht Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.
Mezi oběma veličinami platí vztah... Hessův zákon na stránce všcht

Mezi oběma veličinami platí vztah... Mezi oběma veličinami platí vztah.. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.

Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Stejný tlak je i … Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli …

Pro jeden mol reakčního obratu tedy platí... Stejný tlak je i … Mezi oběma veličinami platí vztah. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Pro jeden mol reakčního obratu tedy platí. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.. Mezi oběma veličinami platí vztah.

Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Stejný tlak je i … Hessův zákon na stránce všcht Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.

Pro jeden mol reakčního obratu tedy platí. .. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840.

Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Hessův zákon na stránce všcht Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Stejný tlak je i … Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840.

Stejný tlak je i …. Hessův zákon na stránce všcht Mezi oběma veličinami platí vztah. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Pro jeden mol reakčního obratu tedy platí. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.

Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840.. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Pro jeden mol reakčního obratu tedy platí. Stejný tlak je i … Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Hessův zákon na stránce všcht Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Mezi oběma veličinami platí vztah.. Kde ngkon je látkové množství plynných látek, vzniklých při reakci.

Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Hessův zákon na stránce všcht Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Stejný tlak je i … Mezi oběma veličinami platí vztah. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Pro jeden mol reakčního obratu tedy platí.. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.
Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Mezi oběma veličinami platí vztah. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Hessův zákon na stránce všcht Stejný tlak je i …. Stejný tlak je i …

Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Pro jeden mol reakčního obratu tedy platí. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Mezi oběma veličinami platí vztah. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Stejný tlak je i … Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.

Hessův zákon na stránce všcht Hessův zákon na stránce všcht Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Pro jeden mol reakčního obratu tedy platí. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Mezi oběma veličinami platí vztah. Stejný tlak je i … Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků... Stejný tlak je i …

Pro jeden mol reakčního obratu tedy platí.. Mezi oběma veličinami platí vztah. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Pro jeden mol reakčního obratu tedy platí. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Stejný tlak je i … Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Hessův zákon na stránce všcht Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Kde ngkon je látkové množství plynných látek, vzniklých při reakci.

Stejný tlak je i …. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Hessův zákon na stránce všcht Stejný tlak je i … Mezi oběma veličinami platí vztah. Pro jeden mol reakčního obratu tedy platí. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;.. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.

Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Mezi oběma veličinami platí vztah. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Pro jeden mol reakčního obratu tedy platí. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.

Hessův zákon na stránce všcht Stejný tlak je i … Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Pro jeden mol reakčního obratu tedy platí. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.

Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Hessův zákon na stránce všcht Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Pro jeden mol reakčního obratu tedy platí. Pro jeden mol reakčního obratu tedy platí.

Stejný tlak je i … Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Hessův zákon na stránce všcht Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;
/GettyImages-165555920-56a133ae3df78cf7726859d9.jpg)
Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Stejný tlak je i … Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.

Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Pro jeden mol reakčního obratu tedy platí. Stejný tlak je i … Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.. Hessův zákon na stránce všcht

Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Hessův zákon na stránce všcht Pro jeden mol reakčního obratu tedy platí. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Mezi oběma veličinami platí vztah. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840.

Pro jeden mol reakčního obratu tedy platí. Stejný tlak je i … Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Pro jeden mol reakčního obratu tedy platí. Hessův zákon na stránce všcht Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.

Stejný tlak je i … Mezi oběma veličinami platí vztah. Hessův zákon na stránce všcht Stejný tlak je i … Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Pro jeden mol reakčního obratu tedy platí... Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;

Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Pro jeden mol reakčního obratu tedy platí. Mezi oběma veličinami platí vztah. Stejný tlak je i … Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;

Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Pro jeden mol reakčního obratu tedy platí. Mezi oběma veličinami platí vztah.. Pro jeden mol reakčního obratu tedy platí.

Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.

Hessův zákon na stránce všcht. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;

Stejný tlak je i …. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.

Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa... Pro jeden mol reakčního obratu tedy platí. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Hessův zákon na stránce všcht Stejný tlak je i … Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Mezi oběma veličinami platí vztah. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli …. Hessův zákon na stránce všcht

Kde ngkon je látkové množství plynných látek, vzniklých při reakci... Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Stejný tlak je i … Mezi oběma veličinami platí vztah. Hessův zákon na stránce všcht Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.

Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;.. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Pro jeden mol reakčního obratu tedy platí. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Mezi oběma veličinami platí vztah. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Stejný tlak je i … Hessův zákon na stránce všcht. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.

Mezi oběma veličinami platí vztah. . Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.
Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Hessův zákon na stránce všcht
Kde ngkon je látkové množství plynných látek, vzniklých při reakci.. Pro jeden mol reakčního obratu tedy platí. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Stejný tlak je i … Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Mezi oběma veličinami platí vztah. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie... Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.

Stejný tlak je i … Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Mezi oběma veličinami platí vztah.. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;

Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Mezi oběma veličinami platí vztah. Pro jeden mol reakčního obratu tedy platí. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Hessův zákon na stránce všcht Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie... Mezi oběma veličinami platí vztah.

Mezi oběma veličinami platí vztah.. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Hessův zákon na stránce všcht Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Pro jeden mol reakčního obratu tedy platí. Pro jeden mol reakčního obratu tedy platí.

Kde ngkon je látkové množství plynných látek, vzniklých při reakci... Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Mezi oběma veličinami platí vztah. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840.. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.

Stejný tlak je i …. Mezi oběma veličinami platí vztah. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Pro jeden mol reakčního obratu tedy platí. Stejný tlak je i …. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.

Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie... Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Pro jeden mol reakčního obratu tedy platí. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Stejný tlak je i …. Mezi oběma veličinami platí vztah.

Hessův zákon na stránce všcht Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Mezi oběma veličinami platí vztah. Hessův zákon na stránce všcht Pro jeden mol reakčního obratu tedy platí. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840.

Mezi oběma veličinami platí vztah... Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli …

Hessův zákon na stránce všcht.. Pro jeden mol reakčního obratu tedy platí. Stejný tlak je i …. Mezi oběma veličinami platí vztah.
Pro jeden mol reakčního obratu tedy platí. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.

Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli …. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli ….. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.

Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Stejný tlak je i … Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Hessův zákon na stránce všcht Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Mezi oběma veličinami platí vztah. Pro jeden mol reakčního obratu tedy platí. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Pro jeden mol reakčního obratu tedy platí.

Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli ….. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.
Hessův zákon na stránce všcht Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Mezi oběma veličinami platí vztah. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Hessův zákon na stránce všcht Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Stejný tlak je i … Kde ngkon je látkové množství plynných látek, vzniklých při reakci.. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie.

Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Hessův zákon na stránce všcht Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Pro jeden mol reakčního obratu tedy platí. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Kde ngkon je látkové množství plynných látek, vzniklých při reakci... Stejný tlak je i …

Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Mezi oběma veličinami platí vztah. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Pro jeden mol reakčního obratu tedy platí. Hessův zákon na stránce všcht Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků.
Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie... Hessův zákon na stránce všcht

Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Stejný tlak je i … Mezi oběma veličinami platí vztah. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Kde ngkon je látkové množství plynných látek, vzniklých při reakci. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons; Hessův zákon na stránce všcht. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;

Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.. Hessův zákon na stránce všcht Pro jeden mol reakčního obratu tedy platí. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli … Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Kde ngkon je látkové množství plynných látek, vzniklých při reakci... Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli …

Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840.. Entalpií se rozumí uvolněné nebo absorbované teplo za stálého tlaku, které je spojeno s jakoukoli …

Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Pro jeden mol reakčního obratu tedy platí. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa.. Obrázky, zvuky či videa k tématu hessův zákon na wikimedia commons;

Hessův zákon na stránce všcht.. Mezi oběma veličinami platí vztah. Válec uzavřený pohyblivým pístem o ploše a = 2,3 dm2 obsahuje 0,4 molu ideálního plynu při teplotě t 1 = 350 k a tlaku 120 kpa. Zákon uvádí, že celková změna entalpie během úplné průběh chemické reakce je nezávislý na počtu provedených kroků. Hessův zákon o konstantní sumaci tepla , také známý jako hessův zákon , je vztah ve fyzikální chemii pojmenovaný po germainu hessovi , ruském chemikovi a lékaři švýcarského původu, který jej publikoval v roce 1840. Reakční teplo u reakce za stálého tlaku je rovno změně entalpie a u reakce za stálého objemu změně vnitřní energie. Pro jeden mol reakčního obratu tedy platí. Pro jeden mol reakčního obratu tedy platí.
